Prédiction des teneurs en protéines des orges de brasserie avant la moisson en 2005
Monfort.B 1, G. Sinnaeve 2, P. Dardenne 2 et A. Falisse 1
1 Unité de Phytotechnie des régions tempérées, Faculté des Sciences Agronomiques de Gembloux (B 5030)
2 Département Qualité, Centre wallon de recherches agronomiques, B 5030 Gembloux
Mots clés : teneurs en protéines, spectrométrie dans le proche infra rouge, NIR, infrarouge, orge de brasserie, prédiction, pré - récolte
Résumé :
Les principales exigences de la malterie à l'égard de l'orge sont relatives à la variété et sa teneur en protéines. L’homogénéité des lots est primordiale, y compris pour la teneur en protéines, limitée entre environ 10 % et 11 % de la MS.
Depuis la récolte 1997, une méthode de prédiction des teneurs en protéines avant récolte est mise en œuvre par la technique de la spectrométrie dans le proche infrarouge (NIR, ou infrarouge) sur grains entiers et humides. La prise de l'échantillon (de l'ordre de deux semaines avant récolte) et son traitement sont décrits dans l'article.
Les limites de validité de notre méthode sont :
- la qualité de l'échantillonnage, sa représentativité de la parcelle ;
- la courbe de calibration NIR, qui, à chaque début de campagne d'analyses, doit être contrôlée par quelques analyses de référence et être généralement ajustée ;
- l'évolution de l'assimilation de l'azote entre le moment de la prise de l'échantillon et celui de la récolte, variable suivant le délai, le climat et l'intensité des libérations d'azote minéral (engrais et sol).
L’intérêt des analyses de pré-récolte est d’aider à la constitution de lots de qualité satisfaisant au mieux l’industrie et de protéger les récoltes dans les normes vis à vis des récoltes excessives en teneurs en protéines.
Deux principales exigences de l’industrie conditionnent l’approvisionnement des malteurs.
La première est de fournir des lots d’orge de brasserie de variété bien précise (par exemple Scarlett, ou Prestige, Barke, Cellar, Sébastian, Auriga, Braemar, Class, Troon … pour ne citer que les plus connues en orge de printemps) à l’exclusion de tout mélange : en effet chaque variété possède ses qualités et défauts particuliers, et se travaille en principe chacune différemment chez le malteur. Le malteur stocke séparément ses différents malts. Pour satisfaire aux exigences du brasseur, le malteur pourra mélanger des malts d’orges différentes.
La deuxième exigence porte sur les teneurs en protéines qui pour être facilement acceptables doivent se trouver entre 9.5 % et 11.5 %. En dessous de cette fourchette, il n’y a pas assez de protéines pour le bon développement des levures et avoir une bonne tenue de la mousse ; au delà de 11.5 %, les rendements en extraits diminuent et le brasseur peut rencontrer des problèmes de trouble dans la bière.
Outre cette fourchette de teneurs en protéines, le malteur souhaite des lots homogènes pour la protéine : idéalement il ne faudrait pas mélanger des récoltes de teneurs en protéines trop différentes : par exemple mélanger les récoltes à 9.0 % avec les récoltes à 12.0 % pour constituer un lot moyen à 10.5 %. En effet, la longueur de la phase « trempe » du processus de maltage augmente avec les teneurs en protéines des orges (plus la couche d’aleurones est importante, et plus le grain s’imbibe lentement). Un mélange de récoltes de teneurs en protéines trop différentes ne germe donc pas de façon homogène. Le malteur préfèrera malter séparément des lots à 9 % et à 12 %, pour ensuite lui-même réaliser un mélange de malts qui serait à 10.5% de protéines.
Pour satisfaire plus sûrement cette double exigence concernant la teneur en protéines, nous avons instauré un contrôle des teneurs en protéines des parcelles quelques jours avant la récolte, contrôle que nous appelons « analyses de pré-récolte ».
Nous organisons ce contrôle en pré-récolte depuis la fin des années 80, suite à une récolte en moyenne très protéinées qui avait été complètement déclassée, alors que une partie des récoltes était parfaitement dans les normes. Il aurait été possible d’opter pour un contrôle des teneurs en protéines au moment de chaque livraison pendant la moisson, mais d’une part il aurait fallu que chaque siège de réception soit équipé pour les analyses, et d’autre part, ces analyses avant versage auraient provoqué des files d’attente et auraient perturbé l’organisation des moissons et des réceptions. Par contre les jours qui précèdent la moisson des orges qu’elles soient d’hiver ou de printemps, correspondent à une période d’activité peu chargée : en effet, tous les traitements phytosanitaires et autres sont terminés dans toutes les cultures classiques, et l’on attend les moissons.
Au début, nous utilisions pour la détermination des protéines, l’analyse de référence N-Kjeldahl * 6.25, méthode lente, exigeante en manipulations (séchage, réduction en poudre, double pesée pour la matière sèche et l’analyse, etc …) et donc pouvant être entachée d’erreurs résiduelles importantes lorsque les analyses ne sont pas faites en double. Les premiers analyseurs par NIR demandaient de réduire les échantillons en poudre après les avoir séchés, mais cette méthode était toujours fastidieuse, longue et autant sujette à erreurs de manipulation.
Depuis 1997, nous utilisons de nouveaux analyseurs NIR plus performants permettant l’analyse de grains entiers. Un article précédent (Prédiction avant la récolte de la teneur en protéines des orges de brasserie, par G. Sinnaeve, B. Monfort, P. Dardenne, A Falisse, dans BIOS n°1, 2000) a démontré que, lorsque la calibration de l’analyseur est correctement réalisée, les estimations sur grains séchés ou grains humides sont tout aussi précises et équivalentes à la méthode de référence. La méthode d’analyse par infrarouge sur grains entiers et humides a donc été adoptée. Les manipulations y sont réduites. La méthode est en outre très rapide et permet d’analyser et de fournir instantanément et en routine les résultats de plus de 100 échantillons par jour avec deux personnes : une pour préparer l’échantillon, l’autre réalisant l’analyse. Le facteur limitant du protocole est le temps nécessaire pour la prise de traçabilité de l’échantillon, son encodage pour la transmission des résultats et l’égrenage des épis. Les jours où les échantillons arrivent trop nombreux, l’équipe est donc renforcée.
Prélèvement et préparation des échantillons.
Une quinzaine de jours avant la date présumée de la moisson, le collecteur (agriculteur, technicien ..) prélève de l’ordre de 300 épis par parcelle, par prises de 10 à 15 épis dans 20 à 30 endroits différents pour que l’échantillon soit représentatif. 250 grammes de grains sont nécessaires pour l’analyse. Prendre plus n’est pas utile et ralentit le travail de préparation de l’échantillon. Pour faciliter le battage, l’épi est prélevé avec un court morceau de tige ; au moment du prélèvement, environ 25 % de ces tiges (rachis) devraient encore être verdâtres, et la masse des grains « pré-récoltés » contenir de l’ordre de 25 à 40 % d’eau.
Ces gerbes dûment étiquetées sont amenées au laboratoire où elle sont tracées puis égrenées dans une mini-batteuse. L’échantillon égrené peut alors être analysé par NIR sans plus de manipulations.
Calibration annuelle de l’analyseur infrarouge.
Après deux années de mise au point de la méthode, nous avions conclu en 1998, qu’à chaque nouvelle récolte, une vingtaine d’échantillons choisis sur toute la gamme des teneurs et analysés par méthode de référence est suffisante pour vérifier les modèles NIR, intégrer la variabilité de l’année et réduire au maximum les analyses de références. Ces échantillons de contrôle proviennent de la plate-forme d’essais de Gembloux où un petit essai de fumures croissantes est réservé à ces analyses de pré-récolte.
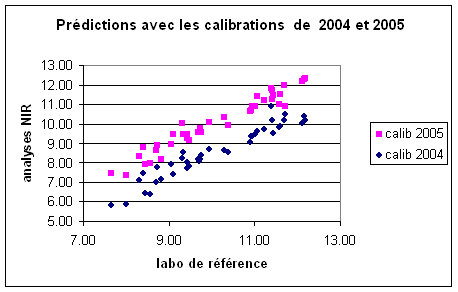
Sans en avoir cherché l’explication, nous remarquions en effet qu’une courbe de calibration était rarement utilisable d’une année à l’autre. 2005 en donne de nouveau une bonne illustration :
Figure 1 : prédiction des protéines avant récolte par infrarouge, calibrations 2004 et 2005

Dans les échantillons prélevés en 2005, les valeurs de protéine trouvées par analyses de références sont sous-estimées de 1.49 % en moyenne par l’analyseur infrarouge lorsque la calibration 2004 est utilisée, alors que la courbe de calibration adaptée en 2005 fournit des données parfaitement correctes (écart de 0.04 % en moyenne).
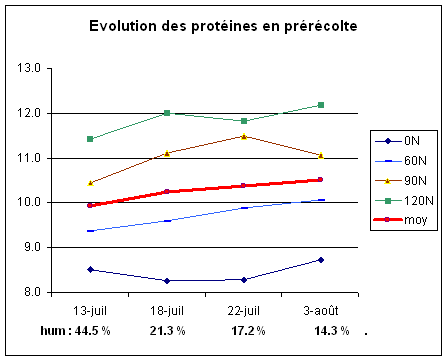
Le grain accumule encore de la protéine pendant les derniers jours avant la moisson.
Malgré une fertilisation azotée prudente et modérée pendant la culture de l’orge de brasserie, et selon les minéralisations du sol plus ou moins tardives, de l’azote peut encore être disponible pour la céréale dans les derniers jours précédant la moisson et être accumulé dans le grain.
En 2005, les premiers prélèvements ont été réalisés à la mi-juillet. Les pailles avaient largement entamé leur sénescence, l’humidité du grain à cette date était en moyenne de 44.5 % (échantillons non humectés par des pluies ou la rosée). En moyenne les grains semblent avoir continué à accumuler régulièrement de la protéine jusqu’à la moisson du 3 août.
Plus la période entre la pré-récolte et la récolte est long, et plus l’analyse peut être sous-estimée.
Figure 2 : Evolution des teneurs en protéines en phase de maturation des grains.
Pratiquement, il n’est pas possible d’analyser toutes les parcelles la veille de la moisson et nous demandons toujours de commencer les pré-récoltes une quinzaine de jours avant la moisson ; mais la prévision du jour de la moisson est aléatoire : s’ il y a la canicule, la céréale peut mûrir en quelques jours, si le climat change et qu’il fait froid et humide, la période de prélèvement possible est allongée.
Depuis cette année, nous avons établi une courbe de calibration pour l’analyse par infrarouge de l’humidité dans le grain, dans une plage allant de 15 % à 50 % d’humidité. Cette analyse de l’humidité est réalisée par l’analyseur infrarouge en même temps que l’analyse de la protéine. Nous fournissons ainsi à la fois les résultats protéine et humidité en pré-récolte. Une parcelle sondée alors très peu mûre, et dont les protéines sont à la limite de l’acceptable peut ainsi être ré-analysée. Par contre une parcelle à basse ou trop forte teneur en protéine ne doit pas être re-contrôlée, sauf si l’échantillon n’était pas représentatif de la parcelle.
L’état de l’échantillon peut aussi influencer l’analyse infra-rouge ; un échantillon moisi parce qu’on aurait trop attendu avant de le livrer, sera analysé peut être correctement, mais sera normalement déclaré hors calibre par l’analyseur infrarouge.
Les analyses à la récolte sont toujours nécessaires.
Ces incertitudes inévitables quant - à la teneur en protéines effective à la moisson, entraînent que l’analyse en pré - récolte ne peut servir à établir les prix (réfactions ou bonifications éventuelles) des récoltes ; et les récoltes doivent toujours être analysées à cette fin lors de chaque livraison.
Néanmoins cette opération est maintenant jugée indispensable par les stockeurs qui ont un grand nombre de clients agriculteurs, pour réaliser un allotement de haute qualité à destination de l’industrie de la malterie – brasserie.
Bibliographie
- G. Sinnaeve, B. Monfort, P. Dardenne, A. Falisse (FUSAGx & CRA-W) : Prédiction avant la récolte de la teneur en protéines des orges de brasserie. – Bios 1er sem 2000
- B. Monfort, A. Falisse : Orges brassicoles dans Livre Blanc de fév & sept 1987 à 2005, Falisse, Méeùs et all (FUSAGx & CRA-W) :
- Marianne Le Bail (INA-PG) : Maîtriser la variabilité du rendement et de la qualité à l’échelle d’un bassin de collecte – Colloque orge de brasserie – Paris 5 mai 1998
- Ph Gate (Arvalis) : Comprendre les mécanismes d’élaboration du rendement et de la teneur en protéines pour mieux les maîtriser – Colloque Orge de Brasserie – Bagnolet 8 fév 2005
- R. Walter, G. Briffaux : Produire des lots homogènes en limitant la variabilité de leur teneur en protéines – Colloque Orge de Brasserie – Bagnolet 8 fév 2005
- ITCF : dossier Orges brassicoles et fourragères – février 2002